Objetivos
1. Identificar diferentes grupos funcionales en los compuestos orgánicos con base en su comportamiento químico.
2. Reconocer a los compuestos orgánicos más importantes como son los alcoholes, aldehídos, cetonas y ácidos orgánicos, a través de sus reacciones características en ensayados comunes de identificación.
Introducción
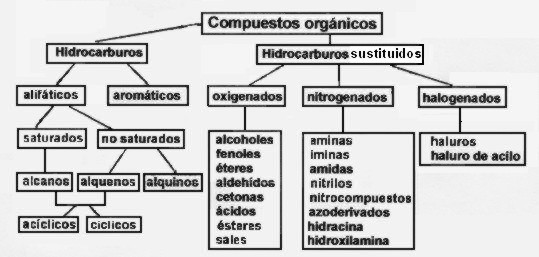
En el transcurso de los años se ha conseguido distribuir los compuestos orgánicos en bloques tales que cada uno se caracteriza por tener un átomo o agrupamiento atómico definido, llamado grupo funcional, que le confiere una serie de propiedades comunes. Así, se puede decir que las moléculas orgánicas están constituidas por una cadena hidrocarbonadade gran estabilidad química y uno o más grupos de átomos, grupos funcionales, donde se localiza la reactividad específica del compuesto. La existencia de estos grupos funcionales, a los que la molécula debe sus propiedades químicas fundamentales, permite clasificar los compuestos orgánicos agrupando en una misma familia de compuestos o función orgánica a todos los compuestos que poseen el mismo grupo funcional. Todos ellos presentan cierta semejanza en sus propiedades químicas. Como la variedad de familias sigue siendo grande, para simplificar su estudio se pueden agrupar aquellas familias de compuestos que presentan alguna analogía.
Identificación de grupos funcionales orgánicos: esta será posible en base a una serie de reacciones características para cada grupo funcional Los ácidos carboxílicos se disuelven en NaOH y bicarbonato acuoso desprendiendo CO2. La identificación de la presencia de alcoholes se basa en que el cloruro de acetilo reacciona vigorosamente con estos para formar un éster y liberar HCl, a su vez, se puede distinguir entre alcoholes primarios, secundarios y terciarios, mediante el reactivo de Lucas (ZnCl2 en HCl conc.), que convierte alcoholes terciarios, rápidamente, en cloruros insolubles, los alcoholes secundarios reaccionan más lentamente y los primarios permanecen inertes. Los aldehídos y cetonas ambos se identifican por reacción con la reactivo de Brady (2,4-dinitrofenilhidrazina), formándose las correspondientes 2,4-dinitrofenilhidrazonas. . El reactivo de Tollens nos permite diferenciar un aldehído de una cetona.
Materiales
Reactivos:
Soda:
a fórmula es un secreto comercial, guardado en un banco en Atlanta. Una leyenda urbana asegura que sólo tienen acceso a ella dos directivos.
El 15 de febrero de 2011, el periódico Time reveló que un grupo de "detectives accidentales", encontró la lista de ingredientes de la Coca-Cola.1
Aunque la empresa refresquera negó que dichas aclaraciones fueran verídicas, varios medios de comunicación ya habían revelado la receta.
La receta es la siguiente según lo publicado:1
- Extracto fluido de Coca: 3 dracmas
- Ácido cítrico: 3 onzas
- Cafeína: 1 onza
- Azúcar: 30 (cantidad no clara)
- Agua: 2.5 galones
- Jugo de lima: 2 pintas, 1 cuarto
- Vainilla: 1 onza
- Caramelo: 1.5 onzas o más para el color
- El sabor secreto 7X (utilice 2 onzas de sabor para un jarabe de 5 galones):
- Alcohol: 8 onzas
- Aceite de naranja: 20 gotas
- Aceite de limón: 30 gotas
- Aceite de nuez moscada: 10 gotas
- Cilantro: 5 gotas
- Nerolí: 10 gotas
- Canela: 10 gotas
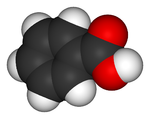
Ácido benzoico
Es un ácido carboxílico aromático que tiene un grupo carboxilo unido a un anillo fenílico.
En condiciones normales se trata de un sólido incoloro con un ligero olor característico. Es poco soluble en agua fría pero tiene buena solubilidad en agua caliente o disolventes orgánicos.
Ácido benzoico | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Ácido benzoico | |||
| General | |||
| Fórmula semidesarrollada | φCOOH | ||
| Fórmula molecular | C6H5-COOH | ||
| Identificadores | |||
| Número CAS | 65-85-0 | ||
| Propiedades físicas | |||
| Densidad | 1320 kg/m3; 1,32g/cm3 | ||
| Masa molar | 122,12 g/mol | ||
| Punto de fusión | 395 K (121,85 °C) | ||
| Punto de ebullición | 522 K (248,85 °C) | ||
| Propiedades químicas | |||
| Solubilidad en agua | 3,4 g/l a 293 K (20°C) 70 g/l a 368 K (95 °C) | ||
| Riesgos | |||
| LD50 | 1.700 mg/kg (rata) LDLo: 500 mg (hombre) | ||
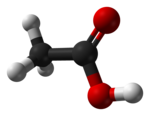
Ácido Acético:
El ácido acético,ácido metilencarboxílico o ácido etanoico, se puede encontrar en forma de ion acetato. Éste es un ácido que se encuentra en elvinagre, siendo el principal responsable de su sabor y olor agrios. Su fórmula es CH3-COOH (C2H4O2). De acuerdo con la IUPAC se denomina sistemáticamente ácido etanoico.
Ácido acético | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Ácido etanoico | |||
| General | |||
| Otros nombres | Ácido acético, Ácido metilencarboxílico, Ácido etanoico | ||
| Fórmula semidesarrollada | HCH2COOH | ||
| Fórmula molecular | CH3COOH1 | ||
| Identificadores | |||
| Número CAS | 64-19-7 | ||
| Propiedades físicas | |||
| Estado de agregación | líquido | ||
| Apariencia | incoloro o cristales (no inodoro) | ||
| Densidad | 1049 kg/m3; 1,049 g/cm3 | ||
| Masa molar | 60.05 g/mol | ||
| Punto de fusión | 290 K (16,85 °C) | ||
| Punto de ebullición | 391,2 K (118,05 °C) | ||
| Propiedades químicas | |||
| Acidez (pKa) | 4,76 | ||
| Momento dipolar | 1,74 D | ||
| Compuestos relacionados | |||
| Ácidosrelacionados | Ácido metanoico Ácido propílico Ácido butírico | ||
| Compuestos relacionados | Acetamida Acetato de etilo, Anhidrido acético, Acetonitrilo, Acetaldehido, Etanol, Cloruro de etanoilo | ||
| Riesgos | |||
| Ingestión | Dolor de garganta, vómito, diarrea, dolor abdominal, sensación de quemazón en el tracto digestivo. | ||
| Inhalación | Dolor de garganta, dificultad respiratoria, tos. | ||
| Piel | Irritación, graves quemaduras. | ||
| Ojos | Irritación, visión borrosa, quemaduras profundas. | ||
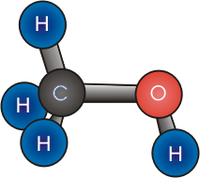
Metanol.
El compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de baja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible. Sufórmula química es CH3OH (CH4O).
Metanol | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Metanol | |||
| General | |||
| Otros nombres | Carbinol Alcohol metílico Alcohol de madera Espíritu de madera. | ||
| Fórmula semidesarrollada | CH3-OH | ||
| Fórmula estructural | Ver imagen. | ||
| Fórmula molecular | CH4O | ||
| Identificadores | |||
| Número CAS | 67-56-1 | ||
| PubChem | |||
| Número RTECS | PC1400000 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido | ||
| Apariencia | Incoloro | ||
| Densidad | 791,8 kg/m3; 0.7918g/cm3 | ||
| Masa molar | 32,04 g/mol | ||
| Punto de fusión | 176 K (-97,16 °C) | ||
| Punto de ebullición | 337,8 K (64,7 °C) | ||
| Viscosidad | 0,59 mPa·s a 20 °C. | ||
| Propiedades químicas | |||
| Acidez (pKa) | ~ 15,5 | ||
| Solubilidad enagua | totalmente miscible. | ||
| KPS | n/d | ||
| Momento dipolar | 1,69 D | ||
| Compuestos relacionados | |||
| Alcoholes | Etanol | ||
| Otros | Metanal | ||
| Termoquímica | |||
| ΔfH0gas | -205±10 kJ/mol | ||
| ΔfH0líquido | -238.4 kJ/mol | ||
| S0líquido, 1 bar | 127.19 J·mol-1·K-1 | ||
| Peligrosidad | |||
| Punto de inflamabilidad | 285 K (12 °C) | ||
| NFPA 704 | |||
| Temperatura de autoignición | 658 K (385 °C) | ||
| Frases R | R11, R23/24/25,R39/23/24/25 | ||
| Frases S | S1/2, S7, S16, S36/37,S45 | ||
| Número RTECS | PC1400000 | ||
| Riesgos | |||
| Ingestión | Puede producir ceguera,sordera y muerte | ||
| Inhalación | Por evaporación de esta sustancia a 20 °C, puede alcanzarse bastante rápidamente una concentración nociva en el aire. | ||
| Piel | Puede producir dermatitis. | ||
| Ojos | Irritación. | ||
Bicarbonato de Sodio
También llamado bicarbonato sódico o hidrogenocarbonato de sodio o carbonato ácido de sodio es un compuesto sólido cristalino de color blanco muy soluble en agua, con un ligero sabor alcalino parecido al del carbonato de sodio, de fórmula NaHCO3. Se puede encontrar como mineral en la naturaleza o se puede producir artificialmente.
mond | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Carbonato ácido de sodio | |||
| General | |||
| Otros nombres | Bicarbonato de sodio Hidrogenocarbonato de sodio | ||
| Fórmula semidesarrollada | NaHCO3 | ||
| Fórmula molecular | n/d | ||
| Identificadores | |||
| Número CAS | 144-55-8 | ||
| Propiedades físicas | |||
| Estado de agregación | Sólido | ||
| Apariencia | blanco cristalino | ||
| Densidad | 2173 kg/m3; 2,173 g/cm3 | ||
| Masa molar | 84,0 g/mol | ||
| Punto de fusión | 323,15 K (50 °C) | ||
| Punto de descomposición | 543,15 K ( °C) | ||
| Índice de refracción | 1,3344 | ||
| Propiedades químicas | |||
| Solubilidad enagua | 10,3 g/100 g de H2O | ||
| Termoquímica | |||
| ΔfH0sólido | -951 kJ/mol | ||
| S0sólido | 102 J·mol-1·K-1 | ||
| Riesgos | |||
| HSci - Safety data | |||
| Ingestión | No peligroso excepto en cantidades muy grandes | ||
| Inhalación | Puede causar irritación | ||
| Piel | Puede causar irritación | ||
| Ojos | Puede causar ceguera | ||
| LD50 | 4220 mg/kg | ||
| Más información | Hazardous Chemical Database (en inglés) | ||
Reactivo de Brady
La 2,4-dinitrofenilhidracina (también conocido reactivo de Brady) es un compuesto orgánico relativamente sensible a golpes y fricción, por lo que debe tener especial cuidado con su uso y suele ser provisto mojado para disminuir el riesgo. Es una hidracina substituída y es usada generalmente como prueba cualitativa para grupos carbonilos.
2,4-dinitrofenilhidrazina | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| 2,4-dinitrofenilhidracina | |||
| General | |||
| Otros nombres | 2,4-DNFH; Reactivo de Brady; 2,4-dinitrofenilhidrazina | ||
| Fórmula semidesarrollada |  | ||
| Fórmula molecular | C6H6N4O4 | ||
| Identificadores | |||
| Número CAS | 119-26-6 | ||
| Propiedades físicas | |||
| Masa molar | 198.14 g/mol | ||
| Punto de fusión | 467 K (193,85 °C) | ||
| Propiedades químicas | |||
Nitrato de Plata
es una sal inorgánica. Este compuesto es muy utilizado para detectar la presencia de cloruro en otras soluciones.
Cuando esta diluido en agua, reacciona con el cobre formando nitrato de cobre, se filtra y lo que se queda en el filtro es plata.
Nitrato de plata | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Trioxonhitrato (V) de plata | |||
| General | |||
| Otros nombres | Nitrato de plata Nitrato argéntico Lapis infernalis CAS=7761-88-8 | ||
| Fórmula semidesarrollada | AgNO3 | ||
| Fórmula molecular | n/d | ||
| Identificadores | |||
| Número CAS | n/d | ||
| Propiedades físicas | |||
| Estado de agregación | Sólido | ||
| Apariencia | Sólido blanco | ||
| Densidad | 4400 kg/m3; 4,4g/cm3 | ||
| Masa molar | 169.87 g/mol | ||
| Punto de fusión | 485 K (212 °C) | ||
| Punto de ebullición | 717 K (444 °C) | ||
| Propiedades químicas | |||
| Solubilidad en agua | 245 g en 100 g de agua | ||
| Peligrosidad | |||
| NFPA 704 | |||
Amoniaco:
Amoníaco | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Trihidruro de nitrógeno | |||
| General | |||
| Otros nombres | Hidruro de nitrógeno (III) Azano Amoníaco Licor de Hartshorn Nitro-Sil Vaporole Gas de amonio AM-FOL | ||
| Fórmula semidesarrollada | NH3 | ||
| Fórmula molecular | n/d | ||
| Identificadores | |||
| Número CAS | 7664-41-7 | ||
| Número RTECS | BO0875000 (anhidro) BQ9625000 (soluciones) | ||
| Propiedades físicas | |||
| Estado de agregación | Gas | ||
| Apariencia | Incoloro Olor penetrante y desagradable | ||
| Densidad | 0.73 kg/m3; 0,00073g/cm3 | ||
| Masa molar | 17,031 g/mol | ||
| Punto de fusión | 195,42 K (-77,73 °C) | ||
| Punto de ebullición | 239,81 K (-33,34 °C) | ||
| Punto de descomposición | 773 K ( °C) | ||
| Temperatura crítica | 405,5 K ( °C) | ||
| Índice de refracción | 1,355 | ||
| Propiedades químicas | |||
| Acidez (pKa) | 9,24 | ||
| Solubilidad enagua | 89,9 g/100 ml (0 °C) | ||
| Momento dipolar | 1,42 D | ||
| Compuestos relacionados | |||
| Hidrurosrelacionados | Arsina Fosfina Estibina Bismutina | ||
| Hidruros de nitrógeno relacionados | Hidrazina Ácido azothídrico | ||
| Otros compuestos | Hidróxido de amonio | ||
| Termoquímica | |||
| ΔfH0gas | -45,92 kJ/mol kJ/mol | ||
| ΔfH0líquido | -40,2 kJ/mol kJ/mol | ||
| S0gas, 1 bar | 192,77 J/mol·K J·mol-1·K-1 | ||
| Calor específico | 4,700 kJ/kg·K (liq) 80,08 kJ/mol·K cal/g | ||
| Peligrosidad | |||
| Punto de inflamabilidad | 284 K (11 °C) | ||
| NFPA 704 | |||
| Temperatura de autoignición | 924 K (651 °C) | ||
| Frases R | R10, R23, R34, R50 | ||
| Frases S | (S1/2), S9, S16, S26, S36/37/39, S45, S61 | ||
| Límites de explosividad | 15–28% | ||
| Número RTECS | BO0875000 (anhidro) BQ9625000 (soluciones) | ||
| Riesgos | |||
| Riesgos | |||
| Ingestión | Es peligroso. Síntomas incluyen náusea y vómitos; daño a los labios, boca y esófago. | ||
| Inhalación | Los vapores son extremadamente irritantes y corrosivos. | ||
| Piel | Soluciones concentradas pueden producir quemaduras severas ynecrosis | ||
| Ojos | Puede causar daños permanentes, incluso en cantidades pequeñas. | ||
| Más información | Hazardous Chemical Database | ||












No hay comentarios:
Publicar un comentario