Objetivos
1. 1- Clasificar algunos compuestos orgánicos teniendo en cuenta su solubilidad.
2. 2- Conocer el carácter polar y apolar de algunos compuestos orgánicos.
3- Verificar las fuerzas intermoleculares en la solubilidad de las sustancias analizadasIntroducción
La solubilidad de una sustancia orgánica en diversos disolventes es un fundamento del método de análisis cualitativo orgánico desarrollado por Kamm, este método se basa en que una sustancia es más soluble en un disolvente cuando sus estructuras están íntimamente relacionadas. Pero dentro de la solubilidad también existen reglas de peso molecular, ubicación en una serie homóloga y los disolventes que causan una reacción química como son los ácidos y las bases, también se incluyen los ácidos orgánicos inertes que forman sales de oxonio y sulfonio.
Independientemente de las causas de la disolución del compuesto que se investiga, se considera que hay disolución cuando 0,05g de la sustancia sólida o 0,1 ml de la sustancia líquida forman una fase homogénea a la temperatura ambiente con 3 ml de solvente.
Solubilidad en agua: En general cuatro tipos de compuestos son solubles en agua, los electrolitos, los ácidos, las bases y los compuestos polares. En cuanto a los electrolitos, las especies iónicas se hidratan debido a las interacciones Ion-dipolo entre las moléculas de agua y los iones. El número
de ácidos y bases que pueden ser ionizados por el agua es limitado, y la mayoría se disuelve por la formación de puentes de hidrógeno. Las sustancias no iónicas no se disuelven en agua, a menos que sean capaces de formar puentes de hidrógeno; esto se logra cuando un átomo de hidrógeno
se encuentra entre dos átomos fuertemente electronegativos, y para propósitos prácticos sólo el flúor, oxígeno y nitrógeno lo forman. Por consiguiente, los hidrocarburos, los derivados halogenados y los tioles son muy poco solubles en agua.
Solubilidad en éter: En general las sustancias no polares y ligeramente polares se disuelven en éter. El que un compuesto polar sea o no soluble en éter, depende de la influencia de los grupos polares con respecto a la de los grupos no polares presentes. En general los compuestos que tengan un solo grupo polar por molécula se disolverán, a menos que sean altamente polares, como los ácidos sulfónicos. La solubilidad en éter no es un criterio único para clasificar las sustancias por solubilidad.
Solubilidad en hidróxido de sodio: Los compuestos que son insolubles en agua, pero que son capaces de donar un protón a una base diluida, pueden formar productos solubles en agua. Así se considera como ácido los siguientes compuestos: aquellos en que el protón es removido de un grupo hidroxilo, como los ácidos sulfónicos, sulfínicos y carboxílicos; fenoles, oximas, enoles, ácidos hidroxámicos y las formas “aci” de los nitro compuestos primarios y secundarios.
El protón es removido de un átomo de azufre, como los trío fenoles y los mercaptanos.
De un átomo de nitrógeno como en las sulfonamidas, N-monoalcohil-sulfonamida- N monoetilsustituidas y aquellos fenoles que tienen sustituyentes en la posición orto.
Solubilidad en ácido sulfúrico concentrado: Este ácido es un donador de protones muy efectivo, y es capaz de protonar hasta la base más débil. Tres tipos de compuestos son solubles en este ácido, los que contienen oxígeno excepto los diariléteres y los perfluoro compuestos que contienen oxígeno, los alquenos y los alquinos, los hidrocarburos aromáticos que son fácilmente sulfonados, tales como los isómeros meta di sustituidos, los trialcohil-sustituidos y los que tienen tres o más anillos aromáticos. Un compuesto que reaccione con el ácido sulfúrico concentrado, se considera soluble aunque el producto de la reacción sea insoluble.
Materiales
1- Gradilla
Una gradilla es una herramienta que forma parte del material de laboratorio (química) y es utilizada para sostener y almacenar gran cantidad de tubos de ensayo, de todos los diámetros y formas.
La gradilla es utilizada más comúnmente en laboratorios clinicos.
Su principal función es facilitar el manejo de los tubos de ensayo. Normalmente es utilizado para sostener y almacenar este material. Este se encuentra hecho de madera, plastico o metal; pero las mas comunes son las de madera.
Tipos de Gradillas:
.Gradillas rectangulares .Gradillas redondas .Gradillas varias .Gradillas en forma de "Z"

2- Tubos de Ensayo
Consiste en un pequeño tubo de vidrio con una punta abierta (que puede poseer una tapa) y la otra cerrada y redondeada, que se utiliza en los laboratorios para contener pequeñas muestras líquidas. Aunque pueden tener otras fases. Como realizar reacciones en pequeña escala.Para calentar durante intervalos cortos a llama directa puede sostenerse el tubo con la mano mediante su parte superior. Si se desea exponerlo más intensamente al calor es necesaria la utilización de pinzas. En ambos casos debe tenerse la precaución de no apuntar con la boca del tubo hacia alguna persona (para evitar proyecciones de la muestra). Los tubos de ensayo no han de llenarse más allá del primer tercio.

3- Espátula
La espátula es una herramienta que se utiliza en el laboratorio para recoger sólidos y poder verterlos en otro sitio.

Reactivos
Suelen tener dos partes, una con una espátula pequeña y otra con una pequeña cuchara más o menos cóncava, aunque existen espátulas que tienen las dos partes iguales; según la naturaleza del sólido a recoger se utiliza una parte u otra.
Son de metal y muy ligeras y se usan casi siempre para tomar pequeñas porciones de sólido, que serán, más tarde, pesadas.

4- Pipeta de 5 ml
La pipeta es un instrumento volumétrico de laboratorio que permite medir alícuota de líquido con bastante precisión. Suelen ser de vidrio. Está formada por un tubo transparente que termina en una de sus puntas de forma cónica, y tiene una graduación (una serie de marcas grabadas) indicando distintos volúmenes.
Dependiendo de su volumen, las pipetas tienen un límite de error.Algunas son graduadas o de simple aforo, es decir que se enrasa una vez en los cero mililitros, y luego se deja vaciar hasta el volumen que se necesite; mientras que otras, las denominadas de doble enrase o de doble aforo, se enrasa en la marca o aforo superior, se deja escurrir el líquido con precaución hasta enrasar en el aforo inferior. Si bien poseen la desventaja de medir un volumen fijo de líquido, las pipetas de doble aforo superan en gran medida a las graduadas en que su precisión es mucho mayor, ya que no se modifica el volumen medido si se les rompe o deforma la punta cónica.

Etanol:
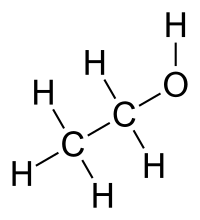
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Etanol | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Etanol | |||
| General | |||
| Fórmula semidesarrollada | CH3-CH2-OH | ||
| Fórmula estructural | CH2OH-CH3 | ||
| Fórmula molecular | C2H6O | ||
| Identificadores | |||
| Número CAS | 64-17-5 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido | ||
| Apariencia | Incoloro | ||
| Densidad | 789 kg/m3; 0,789g/cm3 | ||
| Masa molar | 46,07 g/mol | ||
| Punto de fusión | 158.9 K (-114.3 °C) | ||
| Punto de ebullición | 351.6 K (78.4 °C) | ||
| Temperatura crítica | 514 K ( °C) | ||
| Viscosidad | 1.074 mPa·s a 20 °C. | ||
| Propiedades químicas | |||
| Acidez (pKa) | 15,9 | ||
| Solubilidad en agua | Miscible | ||
| Compuestos relacionados | |||
| alcoholes | Metanol, Propanol | ||
| Termoquímica | |||
| ΔfH0gas | -235,3 kJ/mol | ||
| ΔfH0líquido | -277,6 kJ/mol | ||
| S0líquido, 1 bar | 161,21 J·mol-1·K-1 | ||
| Peligrosidad | |||
| Punto de inflamabilidad | 286 K (13 °C) | ||
| NFPA 704 | |||
| Temperatura de autoignición | 636 K (363 °C) | ||
| Frases R | R11 R61 | ||
| Frases S | S2 S7 S16 | ||
| Límites de explosividad | 3.3 a 19% | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||

Etlendiamida:
es un líquido incoloro con olor a amoníaco que se disuelve en el agua formando una disolución de pH básico. Sus vapores más pesados que el aire son inflamables y pueden producir mezclas explosivas con el aire.Fórmula: H2NCH2CH2NH2 = C2H8N2
Masa molecular: 60,10 g/mol
Punto de fusión: 8 °C
Punto de ebullición: 116,5 °C
Densidad: 0,8995 g/ml
Densidad óptica: nD20 = 1,4568
LD50: 500 mg/kg (rata)
Nº CAS: 107-15-3 o ola
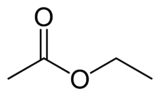
Acetato de etilo:
también llamado acetato de etilo según la IUPAC, y de otras formas (ver tabla) es un éster de fórmula CH3-COO-CH2-CH3. Su nombre antiguo es éter de vinagre, en alemán Essig-Äther, de donde proviene el término "esther" o éster .
El acetato de etilo es un líquido incoloro, característico de los ésteres, no residual. Es miscible con hidrocarburos, cetonas, alcoholes y éteres y poco soluble en agua. Se emplea en arte como disolvente universal.
Acetato de Etilo | |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Acetato de etilo | |||
| General | |||
| Otros nombres | Acetato de etilo; acetidina | ||
| Fórmula semidesarrollada | CH3COOCH2-CH3 | ||
| Fórmula molecular | C4H8O2 | ||
| Identificadores | |||
| Número CAS | 141-78-6 | ||
| Número RTECS | AH5425000 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido incoloro, de olor característico. | ||
| Densidad | 900 kg/m3; 0,9 g/cm3 | ||
| Masa molar | 88,11 g/mol | ||
| Punto de fusión | 189 K (-83 °C) | ||
| Punto de ebullición | 350 K (77 °C) | ||
| Viscosidad | 0,45 cP a 20 °C | ||
| Índice de refracción | 1,3724 a 20 °C | ||
| Propiedades químicas | |||
| Solubilidad enagua | 8,7% a 20 °C | ||
| Momento dipolar | 1,88 a 25 °C D | ||
| Compuestos relacionados | |||
| ácido acético,etanol | |||
| Peligrosidad | |||
| Punto de inflamabilidad | 280 K (7 °C) | ||
| NFPA 704 | |||
| Temperatura de autoignición | 700 K (427 °C) | ||
| Número RTECS | AH5425000 | ||
| Riesgos | |||
| Altamente inflamable. | |||
| Ingestión | Dolor abdominal, vértigo, náusea, dolor de garganta, debilidad. | ||
| Inhalación | Tos, vértigo, somnolencia, dolor de cabeza, náusea, jadeo, dolor de garganta, pérdida de conocimiento, debilidad. | ||
| Piel | Enrojecimiento, dolor. | ||
| LD50 | 11,3 g/kg, rat | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
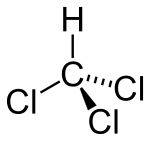
Tricloro metano:
El cloroformo, triclorometano o tricloruro de metilo, es un compuesto químico de fórmula química CHCl3. Puede obtenerse por cloración como derivado del metano o del alcohol etílico o, más habitualmente en la industria farmacéutica, utilizando hierro y ácido sobre tetracloruro de carbono.
Se descompone lentamente por acción combinada del oxígeno y la luz solar, transformándose en fosgeno (COCl2) y cloruro de hidrógeno (HCl) según la siguiente ecuación:
- 2 CHCl3 + O2 → 2 COCl2 + 2 HCl
por lo cual se aconseja conservarlo en botellas de vidrio color ámbar y lejos de la luz.
Cloroformo | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Cloroformo | |||
| General | |||
| Fórmula molecular | CHCl3 | ||
| Identificadores | |||
| Número CAS | 67-66-3 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido | ||
| Apariencia | Incoloro | ||
| Densidad | 1483 kg/m3; 1,483 g/cm3 | ||
| Masa molar | 119,38 g/mol | ||
| Punto de fusión | 209,5 K (-63,65 °C) | ||
| Punto de ebullición | 334,2 K (61,05 °C) | ||
| Estructura cristalina | Tetraédrica | ||
| Índice de refracción | 1.4459 | ||
| Propiedades químicas | |||
| Solubilidad enagua | 0,8 g/100 ml 293,15 K (20 °C) | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
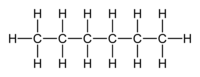
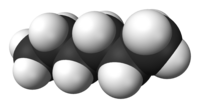
Hexano:
Existen varios isómeros de esta sustancia, siendo la más conocida e importante la del n-hexano:
- CH3 - CH2 - CH2 - CH2 - CH2 - CH3
Otros isómeros son: 2-metilpentano (o isohexano), 3-metilpentano, 2,2-dimetilbutano (o neohexano) y 2,3-dimetilbutano.
Se trata de un líquido incoloro, fácilmente inflamable y con un olor característico a disolvente. Es poco no polar o combinable con el agua, pero se mezcla bien con los disolventes orgánicos apolares como el alcohol, el éter o el benceno. Es muy poco polar por lo que su momento dipolar es casi nulo y sufuerza de elución es muy baja (εº=0,01).
- Concentración máxima permitida en los lugares de trabajo: 50 ppm.
Hexano | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Hexano | |||
| General | |||
| Otros nombres | n-hexano | ||
| Fórmula semidesarrollada | CH3CH2CH2CH2CH2CH3 | ||
| Fórmula molecular | C6H14 | ||
| Identificadores | |||
| Número CAS | 110-54-3 | ||
| Número RTECS | MN9275000 | ||
| Propiedades físicas | |||
| Estado de agregación | líquido | ||
| Apariencia | incoloro | ||
| Densidad | 654.8 kg/m3; 0.6548g/cm3 | ||
| Masa molar | 86,18 g/mol | ||
| Punto de fusión | 178 K (-95,15 °C) | ||
| Punto de ebullición | 342 K (68,85 °C) | ||
| Temperatura crítica | 507.6 K ( °C) | ||
| Viscosidad | 0,294 cP a 25 °C | ||
| Índice de refracción | 1.375 (20 ºC) | ||
| Propiedades químicas | |||
| Solubilidad enagua | 6,1 mg/L | ||
| Momento dipolar | 0 D | ||
| Compuestos relacionados | |||
| Heptano, pentano | |||
| Termoquímica | |||
| ΔfH0gas | -167.1 kJ/mol | ||
| ΔfH0líquido | -198.7 kJ/mol | ||
| S0gas, 1 bar | 388.82 J·mol-1·K-1 | ||
| S0líquido, 1 bar | 296.06 J·mol-1·K-1 | ||
| Peligrosidad | |||
| NFPA 704 | |||
| Temperatura de autoignición | 497 K (224 °C) | ||
| Frases R | R11, R38, R48/20,R51,53, R62, R65, R67, | ||
| Frases S | (S2), S9, S16, S29, S33,S36/37, S61, S62 | ||
| Límites de explosividad | 1.2% - 7.7% | ||
| Número RTECS | MN9275000 | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
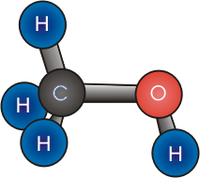
Metanol:
El compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de baja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible. Sufórmula química es CH3OH (CH4O).
Metanol | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Metanol | |||
| General | |||
| Otros nombres | Carbinol Alcohol metílico Alcohol de madera Espíritu de madera. | ||
| Fórmula semidesarrollada | CH3-OH | ||
| Fórmula estructural | Ver imagen. | ||
| Fórmula molecular | CH4O | ||
| Identificadores | |||
| Número CAS | 67-56-1 | ||
| PubChem | |||
| Número RTECS | PC1400000 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido | ||
| Apariencia | Incoloro | ||
| Densidad | 791,8 kg/m3; 0.7918g/cm3 | ||
| Masa molar | 32,04 g/mol | ||
| Punto de fusión | 176 K (-97,16 °C) | ||
| Punto de ebullición | 337,8 K (64,7 °C) | ||
| Viscosidad | 0,59 mPa·s a 20 °C. | ||
| Propiedades químicas | |||
| Acidez (pKa) | ~ 15,5 | ||
| Solubilidad enagua | totalmente miscible. | ||
| KPS | n/d | ||
| Momento dipolar | 1,69 D | ||
| Compuestos relacionados | |||
| Alcoholes | Etanol | ||
| Otros | Metanal | ||
| Termoquímica | |||
| ΔfH0gas | -205±10 kJ/mol | ||
| ΔfH0líquido | -238.4 kJ/mol | ||
| S0líquido, 1 bar | 127.19 J·mol-1·K-1 | ||
| Peligrosidad | |||
| Punto de inflamabilidad | 285 K (12 °C) | ||
| NFPA 704 | |||
| Temperatura de autoignición | 658 K (385 °C) | ||
| Frases R | R11, R23/24/25,R39/23/24/25 | ||
| Frases S | S1/2, S7, S16, S36/37,S45 | ||
| Número RTECS | PC1400000 | ||
| Riesgos | |||
| Ingestión | Puede producirceguera,sordera y muerte | ||
| Inhalación | Por evaporación de esta sustancia a 20 °C, puede alcanzarse bastante rápidamente una concentración nociva en el aire. | ||
| Piel | Puede producir dermatitis. | ||
| Ojos | Irritación. | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
Tolueno (metil benceno):
o metilbenceno, (C6H5CH3) es la materia prima a partir de la cual se obtienen derivados del benceno, el ácido benzoico, elfenol, la caprolactama, la sacarina, el TDI (diisocianato de tolueno) materia prima para la elaboración de poliuretano, medicamentos, colorantes, perfumes, TNT y detergentes.
Su nombre deriva del bálsamo de Tolú extraído del árbol Myroxylon balsamum, del cual Henri Etienne Sainte-Claire Deville lo obtuvo por primera vez en 1844 mediante destilación seca.
Tolueno | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Metilbenceno | |||
| General | |||
| Fórmula semidesarrollada | C6H5CH3 | ||
| Fórmula molecular | C7H8 | ||
| Identificadores | |||
| Número CAS | 108-88-3 | ||
| Propiedades físicas | |||
| Densidad | 866.9 kg/m3; 0.8669 g/cm3 | ||
| Masa molar | 92,14 g/mol | ||
| Punto de fusión | 178 K (-95 °C) | ||
| Punto de ebullición | 383.8 K (110.6 °C) | ||
| Temperatura crítica | 591.64 K ( °C) | ||
| Propiedades químicas | |||
| Solubilidad en agua | 0.05 g/mL | ||
| Compuestos relacionados | |||
| Alcanos | Benceno | ||
| Otros | Ácido benzoico, Fenol | ||
| Peligrosidad | |||
| Punto de inflamabilidad | 277 K (4 °C) | ||
| Temperatura de autoignición | 873 K (600 °C) | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
Urea :
La urea es un compuesto químico cristalino bipolar e incoloro, de fórmula CO(NH2)2. Se encuentra abundantemente en los riñones y en la materia fecal. Es el principal producto terminal del metabolismo de proteínas en el hombre y en los demás mamíferos. La orina humana contiene unos 20g por litro, y un adulto elimina de 25 a 39g diariamente.
En cantidades menores, está presente en la sangre, en el hígado, en la linfa y en los fluidos serosos, y también en los excrementos de los peces y muchos otros animales. También se encuentra en el corazón, en los pulmones, en los huesos y en los órganos reproductivos así como el semen. La urea se forma principalmente en el hígado como un producto final del metabolismo. El nitrógeno de la urea, que constituye el 80% del nitrógeno en la orina, procede de la degradación de los diversos compuestos con nitrógeno, sobre todo de los aminoácidos de las proteínas en los alimentos. En los mamíferos la urea se forma en un ciclo metabólico denominado ciclo de la urea. La urea está presente también en los hongos así como en las hojas y semillas de numerosas legumbres y cereales.
Es soluble en agua y en alcohol, y ligeramente soluble en éter. Se obtiene mediante la síntesis de Wöhler, que fue diseñada en 1828 por el químico alemán Friedrich Wöhler, y fue la segunda sustancia orgánica obtenida artificialmente, luego del oxalato de amonio.
Urea | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Diaminocetona | |||
| General | |||
| Fórmula semidesarrollada | CO(NH2)2 | ||
| Fórmula estructural | Ver imagen. | ||
| Fórmula molecular | CON2H4 | ||
| Identificadores | |||
| Número CAS | [57-13-6 [57-13-6]] | ||
| Propiedades físicas | |||
| Densidad | 1340 kg/m3; 1,34g/cm3 | ||
| Masa molar | 60,06 g/mol | ||
| Punto de fusión | 405.8 K (132.7 °C) | ||
| Propiedades químicas | |||
| Acidez (pKa) | 0.18 | ||
| Solubilidad en agua | En agua: 108 g/100 ml (20 °C) 167 g/100 ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) 733 g/100 ml (100 °C) | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
Etilenglicol:
El etilenglicol (sinónimos: 1,2-Etanodiol, glicol de etileno, glicol) es un compuesto químico que pertenece al grupo de los dioles. El etilenglicol es un líquido transparente, incoloro, ligeramente espeso como el almíbar y leve sabor dulce, son por estas características organolépticas que se suele utilizar distintos colorantes para reconocerlo y asi disminuir las intoxicaciones por accidentes. A temperatura ambiente es poco volátil, pero puede existir en el aire en forma de vapor, el etilenglicol es inodoro pero tiene un sabor dulce. Se fabrica a partir de la hidratación del óxido de etileno (epóxido cancerígeno).
Se utiliza como anticongelante en los circuitos de refrigeración de motores de combustión interna, como difusor del calor, para fabricar compuestos depoliéster, y como disolventes en la industria de la pintura y el plástico. El etilenglicol es también un ingrediente en líquidos para revelar fotografías, fluidos para frenos hidráulicos y en tinturas usadas en almohadillas para estampar, bolígrafos, y talleres de imprenta.
Etilenglicol | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| 1,2-Etanodiol | |||
| General | |||
| Fórmula molecular | C2H6O2 | ||
| Identificadores | |||
| Número CAS | 107-21-1 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido | ||
| Apariencia | Incoloro | ||
| Densidad | 1.116 kg/m3; 1.116g/cm3 | ||
| Masa molar | 62,068 g/mol | ||
| Punto de fusión | 260 K (-13,15 °C) | ||
| Punto de ebullición | 470 K (196,85 °C) | ||
| Viscosidad | 1.61 Pa 1 | ||
| Propiedades químicas | |||
| Solubilidad en agua | Miscible | ||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
Procedimiento












No hay comentarios:
Publicar un comentario