Objetivos
· 1- Realizar pruebas de solubilidad a un compuesto sólido para encontrar el disolvente más adecuado para efectuar una cristalización.
· 2- Comprobar la purificación de sustancias solidas a través de la recristalización basándonos en el aumento de solubilidad que experimentan la mayor parte de los sólidos en un disolvente al aumentar la temperatura.
Introducción
Escoger un disolvente adecuado es uno de los pasos más importantes en esta clase de purificación. Para que el compuesto se pueda diluir en el disolvente, este necesita tener características físicas y estructurales similares mas no iguales, de modo que pueda disolverse para eliminar los contaminantes, pero al enfriarse se pueda separar del disolvente y recuperar los cristales. Las características esenciales para un buen disolvente son:- Disolver todo el compuesto en el punto de ebullición del solvente- Disolver muy poco o nada del soluto en temperatura ambiente- Tener diferentes solubilidades para el compuesto y las impurezas- Tener un punto de ebullición por debajo del punto de fusión del compuesto- Poseer un punto de ebullición relativamente bajo, entre 60 y 100º C- No reaccionar con el compuesto- Ser barato, no tóxico y no inflamable Una vez escogido el disolvente apropiado, este se calienta hasta el punto de ebullición, de modo que cuando se mezcle con la sustancia impura se disuelvan todos los elementos solubles.Un paso muy importante es agregar carbón activado para eliminar las sustancias coloreadas. El carbón activado es un material con importantes propiedades de adsorción: cualidad de un cuerpo de atraer a otro, es decir de cierta fuerza de atracción. Esta adherencia se debe al campo de fuerzas moleculares que se crean en la superficie del sólido. Mediante el proceso de adsorción, una sustancia contaminante se introduce en una superficie (carbón activado), dado que la sustancia es atraída a la superficie adsorbente más que al propio disolvente en el que se encuentra.Luego de realizar la disolución, se procede a filtrarla por el método de gravedad. En este se utiliza en embudo de espiga con un filtro doblado en forma de abanico, de esta forma los contaminantes de mayor tamaño como el aserrín y el carbón activado con las sustancias coloreadas se quedan en el filtro, mientras que el disolvente, el ácido benzoico y la sal pasan al Erlenmeyer. Durante esta etapa se deben considerar los siguientes cuidados: el Erlenmeyer y el embudo deben estar previamente calentados, de lo contrario la mezcla filtrada puede bajar mucho su temperatura y la sustancia se cristalizará antes de tiempo, lo cual resulta en una pérdida de masa al permanecer en el papel o el embudo; el filtro debe doblarse de manera que queden el mayor número de dobleces posibles, esto para abarcar la mayor área superficial de la disolución y no dejar pasar los contaminantes más grandes.Ahora que se tiene la disolución homogénea se lleva a cabo la recristalización. Simplemente, el Erlenmeyer con la mezcla se deja enfriar a temperatura ambiente, hasta que aparezcan los primeros cristales de la sustancia. Es esencial mantener la temperatura ambiental al principio, ya que si los cristales se enfrían muy rápido estos resultarán muy pequeños, de modo que absorberán impurezas del disolvente. Después de unos minutos, ya se puede sumergir el Erlenmeyer en un baño de agua fría, y así asegurar la máxima cristalización posible.Cuando los cristales estén formados se debe pasar al segundo tipo de filtración, la filtración al vacío. La disolución recristalizada se coloca en el embudo de Büchner con papel de filtro, así el disolvente con la sal pasa al Erlenmeyer colocado abajo, debido a que se forma una disolución homogénea y el papel de filtro no los puede detener, es por esta razón que se nota una espuma que desciende hacia el Erlenmeyer, la cual se forma por la succión y la presencia de sal. En cambio, los cristales de ácido benzoico se quedan encima del filtro debido al gran tamaño que han obtenido al cristalizarse. Ahora se procede a realizar lavados en los cristales con el disolvente original, hasta que estos se encuentren lo suficientemente libres de impurezas. El método para cerciorar esto es la prueba de cloruros.Al realizar la prueba de cloruros, se adiciona nitrato de plata a la disolución para que reaccione con el ácido clorhídrico, lo cual hace que el liquido adquiera un color blanco “lechoso”. Así se puede saber si la sal ha sido eliminada de la sustancia purificada, ya que si se adhiere el nitrato de plata y no hay cambio de color, significa que toda o la mayor parte de la sal ha sido eliminada.El último paso de la cristalización es el secado de los cristales purificados. Hay varias opciones para realizar el secado; los cristales se pueden dejar secando al aire libre para que la humedad se evapore poco a poco, pueden meterse en un horno con una temperatura menor al punto de fusión de la sustancia, o usar una lámpara infrarroja.
Materiales:
La cristalización se puede considerar como el método más importante para purificar compuestos sólidos orgánicos. Debido a que muchas especies orgánicas se encuentran contaminadas en la naturaleza, se debe de recurrir a un método para purificarlas, pero obteniendo una masa que sea comparable con la sustancia impura inicial. Este procedimiento se puede dividir en siete pasos para realizar con éxito la purificación; los pasos son: escoger el disolvente apropiado, disolver el soluto, eliminar las sustancias coloreadas, cristalizar el soluto, recolectar y lavar los cristales y secar el producto.
Materiales:
1- Matraz o frasco de Erlenmeyer
El Es un frasco transparente de forma cónica con una abertura en el extremo angosto, generalmente prolongado con un cuello cilíndrico, que suele incluir algunas marcas.
Por su forma es útil para realizar mezclas por agitación y para la evaporación controlada de líquidos; además, su abertura estrecha permite la utilización detapones. El matraz de Erlenmeyer no se suele utilizar para la medición de líquidos ya que sus medidas son imprecisas. Fue creado por el químico Emil Erlenmeyeren 1861.

2- Probeta
La probeta o cilindro graduable es un instrumento volumétrico, que permite medir volúmenes considerables con un ligero grado de inexactitud. Sirve para contener liquidos.
Está formado por un tubo generalmente transparente de unos centímetros de diámetro, y tiene una graduación (una serie de marcas grabadas) desde 0 ml(hasta el máximo de la probeta) indicando distintos volúmenes. En la parte inferior está cerrado y posee una base que sirve de apoyo, mientras que la superior está abierta (permite introducir el líquido a medir) y suele tener un pico (permite verter el líquido medido). Generalmente miden volúmenes de 25 ó 50 ml, pero existen probetas de distintos tamaños; incluso algunas que pueden medir un volumen hasta de 2000 ml.

Están hechos de vidrio y se utilizan para agitar o mover sustancias, es decir, facilitan la homogenización.

Es una pieza del material de laboratorio de química utilizado para realizar filtraciones. Tradicionalmente se produce en porcelana, por lo que se lo clasifica entre el material de porcelana. Pero también hay disponibles en vidrio y plástico, a causa de su bajo costo y menor fragilidad, utilizados principalmente en escuelas secundarias.

5- Embudo de Vidrio
Se emplea para trasvasar líquidos o disoluciones de un recipiente a otro y también para filtrar, en este caso se coloca un filtro de papel cónico o plegado.
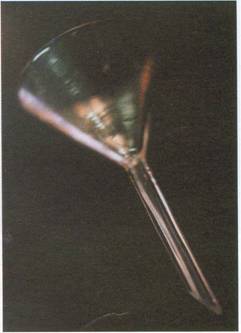
Recipiente de vidrio con rama lateral para conectar con la bomba de vacío (normalmente, una trompa de agua).

7- Vaso Químico
Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos). Se pueden calentar (pero no directamente a la llama) con ayuda de una rejilla.
Reactivos:
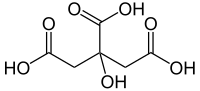
1- Ácido Cítrico:
Es un ácido orgánico tricarboxílico que está presente en la mayoría de las frutas, sobre todo en cítricos como el limón y la naranja. Su fórmula química es C6H8O7.
Es un buen conservante y antioxidante natural que se añade industrialmente como aditivo en el envasado de muchos alimentos como las conservas de vegetales enlatadas.
En bioquímica aparece como un metabolito intermediario en el ciclo de los ácidos tricarboxílicos, proceso realizado por la mayoría de los seres vivos.
El nombre IUPAC del ácido cítrico es ácido 2-hidroxi-1,2,3-propanotricarboxílico.
Ácido cítrico | |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Ácido 2-hidroxi- 1,2,3-propanotricarboxílico | |||
| General | |||
| Otros nombres | Ácido cítrico | ||
| Fórmula molecular r | C6H8O7 | ||
| Identificadores | |||
| Número CAS | 77-92-9 | ||
| Propiedades físicas | |||
| Densidad | 1665 kg/m3; 1,665g/cm3 | ||
| Masa molar | 192,13 g/mol | ||
| Punto de fusión | 448 K (175 °C) | ||
| Propiedades químicas | |||
| Acidez (pKa) | 1=3,15; 2=4,77; 3=6,40 | ||
| Solubilidad enagua | 133 g/100 ml (22 °C) | ||
| Riesgos | |||
| Irrita piel y ojos. | |||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias |
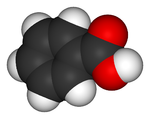
A 2- Ácido Benzoico
El ácido benzoico es un ácido carboxílico aromático que tiene un grupo carboxilo unido a un anillo fenílico.
En condiciones normales se trata de un sólido incoloro con un ligero olor característico. Es poco soluble en agua fría pero tiene buena solubilidad en agua caliente o disolventes orgánicos.
Ácido benzoico | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Ácido benzoico | |||
| General | |||
| Fórmula semidesarrollada | φ COOH | ||
| Fórmula molecular | C6H5-COOH | ||
| Identificadores | |||
| Número CAS | 65-85-0 | ||
| Propiedades físicas | |||
| Densidad | 1320 kg/m3; 1,32g/cm3 | ||
| Masa molar | 122,12 g/mol | ||
| Punto de fusión | 395 K (121,85 °C) | ||
| Punto de ebullición | 522 K (248,85 °C) | ||
| Propiedades químicas | |||
| Solubilidad en agua | 3,4 g/l a 293 K (20°C) 70 g/l a 368 K (95 °C) | ||
| Riesgos | |||
| 1.700 mg/kg (rata) LDLo: 500 mg (hombre) | |||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||
3- Naftaleno:
La naftalina (nombre comercial del naftaleno, C10H8) es un sólido blanco que se volatiliza fácilmente y se produce naturalmente cuando se queman combustibles. También se llama alquitrán blanco y se ha usado en bolas y escamas para ahuyentar las polillas. Quemar tabaco o madera produce naftalina. Tiene un olor fuerte, aunque no desagradable. La 1-metilnaftalina y la 2-metilnaftalina son compuestos similares a la naftalina. La 1-metilnaftalina es un líquido transparente y la 2-metilnaftalina es un sólido; ambos pueden olerse en el aire y en el agua en concentraciones muy bajas. Su temperatura de fusión es 80 °C. Calor latente de fusión LF = 35,6 cal/g. El calor específico es 0,41 cal/g °C = 1,72 KJ/kg-K = 0,239 cal/g-K = 0,41 BTU/lb°F. Es soluble en grasas.Naftalina | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| biciclo(4.4.0)deca-1,3,5,7,9-Hexeno | |||
| General | |||
| Otros nombres | Neftaleno | ||
| Fórmula molecular | C10H8 | ||
| Identificadores | |||
| Número CAS | 91-20-3 | ||
| Número RTECS | QJ0525000 | ||
| Propiedades físicas | |||
| Estado de agregación | sólido | ||
| Apariencia | Cristales blancos / hojuelas, fuerte olor | ||
| Densidad | 1140 kg/m3; 1,14g/cm3 | ||
| Masa molar | 128,17052 g/mol | ||
| Punto de fusión | 353 K (79,85 °C) | ||
| Punto de ebullición | 491 K (217,85 °C) | ||
| Propiedades químicas | |||
| Solubilidad en agua | No soluble en agua | ||
| Peligrosidad | |||
| Punto de inflamabilidad | 356 K (83 °C) | ||
| NFPA 704 | |||
| Temperatura de autoignición | 798 K (525 °C) | ||
| Número RTECS | QJ0525000 | ||
| Riesgos | |||
| Inflamable, sensibilizante, posible carcinogeno. En polvo puede formar una mezcla explosiva con el aire | |||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||





ME PARECE UN BLOGG MUY INTERESANTE,.,....
ResponderEliminar