Objetivos:
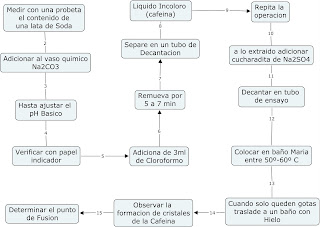
1- Extraer la Cafeína de Bebidas que contienen cola mediante extracción de Liquido-Liquido.2- Determinar el punto de Fusión de la Cafeina extraída.
Introducción:
La extracción es un procedimiento de separación de una sustancia que puede disolverse en dos disolventes no miscibles entre sí, con distinto grado de solubilidad y que están en contacto a través de una interfase. La relación de las concentraciones de dicha sustancia en cada uno de los disolventes, a una temperatura determinada, es constante. Esta constante se denomina coeficiente de reparto y puede expresarse como:K = [sustancia]1/[sustancia]2
donde [sustancia]1 es la concentración de la sustancia que se pretende extraer, en el primer disolvente y, análogamente [sustancia]2 la concentración de la misma sustancia en el otro disolvente.
Si tenemos una sustancia soluble en un disolvente, pero más soluble en un segundo disolvente no miscible con el anterior, puede extraerse del primero, añadiéndole el segundo, agitando la mezcla, y separando las dos fases.
A nivel de laboratorio el proceso se desarrolla en un embudo de decantación. Como es esperable, la extracción nunca es total, pero se obtiene más eficacia cuando la cantidad del segundo disolvente se divide en varias fracciones y se hacen sucesivas extracciones que cuando se añade todo de una vez y se hace una única extracción.
Con relativa frecuencia aparecen en el proceso de extracción emulsiones o interfases que impiden una correcta separación en el embudo dedecantación de las capas de disolventes, casi siempre acuosa y orgánica. Este problema se da, especialmente, cuando se trata de extracciones concloruro de metileno. Para solventar este problema es conveniente añadir unos mililitros de salmuera y agitar de nuevo. En la mayor parte de los casos se produce la separación de las fases sin problemas.
El proceso tiene repercusión industrial y se emplea en extracción de aceites, grasas y pigmentos. Por ejemplo, el yodo, poco soluble en agua, se extrae de la misma con tetracloruro de carbono. Una vez efectuada la separación de las fases se trata de calcular la concentración del yodo en cada fase, valorándolo con tiosulfato.
Este proceso puede usarse también si controlando la solubilidad de nuestras sustancias en distintos disolventes. Especialmente en química orgánica, mediante distintos tratamientos a algunos grupos funcionales podemos controlar el valor de K, haciéndolos así insolubles o solubles según nos interese, por ejemplo: si tenemos aminas disueltas en un disolvente orgánico y queremos pasarlas a una disolvente polar, podemos tratarlas con ácido para cargarlas y que se protonen, disolviéndose así en nuestro disolvente polar, una vez separado hacemos el proceso contrario (es decir basificarlas y devolverlas a su forma original) y las separamos totalmente de nuestros disolventes.
Materiales:
-2 VASOS PRECIPITADOS DE 250 ML-1 PROBETA GRADUADA DE 100 ML
-1 BALÓN AFORADO DE 100 ML
-1 EMBUDO DE SEPARACIÓN
-1 MONTAJE FILTRACIÓN AL VACIO
-1 AGITADOR DE VIDRIO
-1 PLACA DE CALENTAMIENTO
-1 BALANZA
-1 ARO
Reactivos:
El carbonato sódico es una sal blanca y translúcida de fórmula química Na2CO3, usada entre otras cosas en la fabricación de jabón, vidrio y tintes. Es conocido comúnmente como barrilla, natrón, soda Solvay, ceniza de soda y sosa (no confundir con la sosa cáustica o la soda cáustica).
Puede hallarse en la naturaleza u obtenerse artificialmente, gracias a un proceso ideado y patentado en 1791 por el médico y químico francés Nicolás Leblanc. El método Leblanc implicaba las siguientes reacciones químicas:
- Reacción de la sal común con el ácido sulfúrico: 2 NaCl + H2SO4 → Na2SO4 + 2 HCl
- Reacción de calcinación del Na2SO4 con caliza y carbón: Na2SO4 + CaCO3 + 2 C → Na2CO3 + CaS + 2 CO2
Más adelante este método fue sustituido por ideado por el químico belga Ernest Solvay. Solvay fundó en 1863 la compañía Solvay donde utilizó profusamente su método que conseguía abaratar aún más el proceso y eliminar algunos de los problemas que presentaba el método Leblanc. Éste método utiliza como materias primas el cloruro sódico (sal común), el amoníaco y el carbonato cálcico (piedra caliza).
En 1915 se cerró la última fábrica de sosa Leblanc.
Carbonato de sodio | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Carbonato de sodio | |||
| General | |||
| Otros nombres | Barrilla natrón sosa Solvay ceniza de soda sosa E-500 sosa calcinada soda ash cristales de soda xoda lavada | ||
| Fórmula semidesarrollada | Na2CO3 | ||
| Fórmula molecular | n/d | ||
| Identificadores | |||
| Número CAS | 497-19-8 | ||
| Número RTECS | VZ4050000 | ||
| Propiedades físicas | |||
| Estado de agregación | Sólido | ||
| Apariencia | Sólido blanco | ||
| Densidad | 2540 kg/m3; 2,54 g/cm3 | ||
| Masa molar | 105.9885 g/mol | ||
| Punto de fusión | 1124 K (851 °C) | ||
| Punto de ebullición | 1873 K (1600 °C) | ||
| Propiedades químicas | |||
| Solubilidad enagua | 10,9 g por cada 100 g de agua | ||
| Termoquímica | |||
| ΔfH0líquido | -1102 kJ/mol | ||
| ΔfH0sólido | -1131 kJ/mol | ||
| S0sólido | 135 J·mol-1·K-1 | ||
| Peligrosidad | |||
| NFPA 704 | |||
| Frases R | R36 | ||
| Frases S | (S2), S22, S26 | ||
| Número RTECS | VZ4050000 | ||
| Riesgos | |||
| Ingestión | Causa irritación. | ||
| Inhalación | Dañina, deben evitarse especialmente exposiciones prolongadas. | ||
| Piel | Irritaciones y posiblemente quemaduras. | ||
| Ojos | Irritación grave, posiblemente con heridas graves. | ||
Cloroformo:
El cloroformo, triclorometano o tricloruro de metilo, es un compuesto químico de fórmula química CHCl3. Puede obtenerse por cloración como derivado del metano o del alcohol etílico o, más habitualmente en la industria farmacéutica, utilizando hierro y ácido sobre tetracloruro de carbono.
A temperatura ambiente, es un líquido volátil, no inflamable, incoloro, de olor dulzón.1 2 3
Se descompone lentamente por acción combinada del oxígeno y la luz solar, transformándose en fosgeno (COCl2) y cloruro de hidrógeno (HCl) según la siguiente ecuación:
- 2 CHCl3 + O2 → 2 COCl2 + 2 HCl
por lo cual se aconseja conservarlo en botellas de vidrio color ámbar y lejos de la luz.
Cloroformo | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Cloroformo | |||
| General | |||
| Fórmula molecular | CHCl3 | ||
| Identificadores | |||
| Número CAS | 67-66-3 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido | ||
| Apariencia | Incoloro | ||
| Densidad | 1483 kg/m3; 1,483 g/cm3 | ||
| Masa molar | 119,38 g/mol | ||
| Punto de fusión | 209,5 K (-63,65 °C) | ||
| Punto de ebullición | 334,2 K (61,05 °C) | ||
| Estructura cristalina | Tetraédrica | ||
| Índice de refracción | 1.4459 | ||
| Propiedades químicas | |||
| Solubilidad enagua | 0,8 g/100 ml 293,15 K (20 °C) | ||
Sulfato de Sodio Anhidro:
El sulfato de sodio o sulfato sódico (Na2SO4) es una sustancia incolora, cristalina con buena solubilidad en el agua y mala solubilidad en la mayoría de los disolventes orgánicos con excepción de la glicerina.
Sulfato de sodio | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Sulfato (VI) de sodio | |||
| General | |||
| Otros nombres | Sulfato de sodio Sulfato sódico | ||
| Fórmula semidesarrollada | Na2SO4 | ||
| Fórmula molecular | n/d | ||
| Identificadores | |||
| Número CAS | 7757-82-6 7727-73-3 (decahidratado) | ||
| Propiedades físicas | |||
| Estado de agregación | Sólido | ||
| Apariencia | Sólido cristalino blanco | ||
| Densidad | 2.68 g/cm3 (anhidro) 1.464 g/cm3 (decahidrato)kg/m3; Expresión errónea: palabra "g" desconocida g/cm3 | ||
| Masa molar | 142.04 g/mol (anhidro) 322.20 g/mol (decahidro)g/mol | ||
| Punto de fusión | 1157 (anhidro) 305.4 (decahidro) K (884 (anhidro) 32.4 (decahidro) °C) | ||
| Propiedades químicas | |||
| Solubilidad enagua | 4.76 g/100 ml (0 °C) 42.7 g/100 ml (100 °C) | ||
Coca Cola:
Es un refresco efervescente vendido en tiendas, restaurantes y máquinas expendedoras en más de 200 países. Es producido por The Coca-Cola Company. En un principio, cuando la inventó el farmacéutico John Pemberton, fue una medicina patentada, aunque fue adquirida posteriormente por el empresario Asa Griggs Candler, cuyas tácticas de márketing hicieron a la bebida una de las más consumidas del siglo XX.
La compañía produce realmente un concentrado de Coca-Cola, que luego vende a varias empresas embotelladoras licenciadas, las cuales mezclan el concentrado con agua filtrada y edulcorantes para, posteriormente, vender y distribuir la bebida en latas y botellas en los comercios minoristas o mayoristas.
También existen variantes de la Coca-Cola, fabricados por la misma empresa, como la Coca-Cola Light y la Coca-Cola Diet; otras son la Coca-Cola sin cafeína, Coca-Cola Cereza, Coca-Cola Vainilla, Coca-Cola Zero, entre otras lanzadas especialmente como la de sabor a limón.
La receta es la siguiente según lo publicado:1
- Extracto fluido de Coca: 3 dracmas
- Ácido cítrico: 3 onzas
- Cafeína: 1 onza
- Azúcar: 30 (cantidad no clara)
- Agua: 2.5 galones
- Jugo de lima: 2 pintas, 1 cuarto
- Vainilla: 1 onza
- Caramelo: 1.5 onzas o más para el color
- El sabor secreto 7X (utilice 2 onzas de sabor para un jarabe de 5 galones):
- Alcohol: 8 onzas
- Aceite de naranja: 20 gotas
- Aceite de limón: 30 gotas
- Aceite de nuez moscada: 10 gotas
- Cilantro: 5 gotas
- Nerolí: 10 gotas
- Canela: 10 gotas
Según el Time, la fotografía utilizada para ilustrar la nota es una copia escrita a mano de la receta original de John Pemberton, escrita por un amigo en un libro de cuero de recetas de ungüentos y medicinas, y pasado de amigos a familiares por generaciones.




No hay comentarios:
Publicar un comentario