Objetivos:
1- Aplicar la técnica de destilación como técnica de separación y purificación del alcohol.
2- Adquirir destrezas en armar un sistema de destilación simple y fraccionada.
Introducción
Las substancias con cadenas largas tendrán alta temperaturas de ebullición que aquellos con cadenas cortas y al aumentar las ramificaciones elpunto de ebullición disminuirá. Si la diferencia entre los puntos de ebullición de ambos componentes de la mezcla es al menos de 80º C es más conveniente utilizar destilación simple, y si es menor a esta temperatura es más conveniente usar destilación fraccionada por la calidad de la substancia pura que resulta.
Antecedentes:
La destilación es un proceso que consta de: la vaporización de un líquido, su condensación y la recolección del condensado. La destilación es un método de purificación cuando existen una pequeña cantidad de impurezas en el líquido a destilar y un método de separación en una mezcla. Existen 4 métodos de destilación, la fraccionada, la simple, a presión reducida y destilación por arrastre de vapor.
Cuando se tiene una estructura ramificada ó al aumentar las ramificaciones en una molécula, la forma de esta tiende a aproximarse a la de una esfera, disminuyendo la superficie de contacto con otras moléculas y por ende la desestabilización de las fuerzas intermoleculares. En los hidrocarburos, uno de los factores que determina el punto de ebullición son el peso molecular y las fuerzas de Van der Waals. Entre más grande sea una cadena y por consiguiente su superficie más intensas son sus fuerzas intermoleculares. El punto de ebullición aumenta al aumentar su peso molecular y el número de carbonos en la cadena.
Los alcoholes también exhiben un aumento en el punto de ebullición, esto se debe a que los alcoholes forman puentes de hidrógeno entre las separación de mezclas líquidas se lleva a cabo en muchas de nuestras industrias, centros de investigación, etcétera. Esto tiene suma importancia económica en casos como el fraccionamiento de los componentes del petróleo, proceso que se lleva a cabo en las refinerías (Ej. Ñico López, Cabaiguán, etcétera).
Antecedentes:
La destilación es un proceso que consta de: la vaporización de un líquido, su condensación y la recolección del condensado. La destilación es un método de purificación cuando existen una pequeña cantidad de impurezas en el líquido a destilar y un método de separación en una mezcla. Existen 4 métodos de destilación, la fraccionada, la simple, a presión reducida y destilación por arrastre de vapor.
Cuando se tiene una estructura ramificada ó al aumentar las ramificaciones en una molécula, la forma de esta tiende a aproximarse a la de una esfera, disminuyendo la superficie de contacto con otras moléculas y por ende la desestabilización de las fuerzas intermoleculares. En los hidrocarburos, uno de los factores que determina el punto de ebullición son el peso molecular y las fuerzas de Van der Waals. Entre más grande sea una cadena y por consiguiente su superficie más intensas son sus fuerzas intermoleculares. El punto de ebullición aumenta al aumentar su peso molecular y el número de carbonos en la cadena.
Los alcoholes también exhiben un aumento en el punto de ebullición, esto se debe a que los alcoholes forman puentes de hidrógeno entre las separación de mezclas líquidas se lleva a cabo en muchas de nuestras industrias, centros de investigación, etcétera. Esto tiene suma importancia económica en casos como el fraccionamiento de los componentes del petróleo, proceso que se lleva a cabo en las refinerías (Ej. Ñico López, Cabaiguán, etcétera).
La destilación del alcohol etílico es también un proceso de suma importancia que se efectúa para su purificación y concentración parcial en las destilerías de nuestro país (Ej. destilería del Central George Washington), por lo que todo ingeniero debe conocer los principios básicos que gobiernan estaos procesos.
Materiales:
Balanza, recipiente apropiado para la fermentación, potenciómetro o phmetro.
Sistema de destilación simple y fraccionada.
Reactivos:
Jugo de Piña
La piña es excelente para las dietas adelgazantes, así como para la salud en general, pues la piña es una fruta que lo tiene todo. Las propiedades y los beneficios de la piña son múltiples y su valor nutricional es excepcional.

Qué contiene la piña (vitaminas y minerales):
Vitaminas de la piña:
• Mucha C, B1, B6 y un poco de E.
Minerales de la piña:
• Potasio, magnesio, yodo, cobre, hierro, fosforo, magnesio, azufre, manganeso.
Otras propiedades de la piña:
• Acido Fólico, acido cítrico, acido málico, acido oxálico, enzima bromalina.
Beneficios de la piña natural:
• Cura especialmente la difteria y las fiebres infecciosas.
• Debido a las enzimas que poseen activan el metabolismo.
• Son germicidas y magníficos en general.
• Comiéndola y tomando, el jugo curan todos los males de garganta, para los cuales son sorprendentes.
• Facilitan la eliminación de grasa, ayudando a adelgazar.
• Normaliza la digestión y facilita la secreción gástrica.
• Son antiinflamatorias.
• A los enfermos de reumatismo y estreñimiento crónico e incurable, así como los nefríticos se les recomienda comer piñas maduras.
• Son altamente depurativos de la sangre.
• En la difteria no hay remedio que les iguale, ya sea comiéndolos o tomando el jugo, y haciendo gárgaras con el mismo.
• Tiene excelentes efectos diuréticos, para la retención de líquidos.
• Curan la arteriosclerosis y la anemia.
• Curan el artritismo.
• Es fuente de azúcares simples, sacarosa, fructosa y glucosa.
• En las fiebres son atemperantes (disminuyen la temperatura).
• Debido a algunas de sus propiedades como la vitamina C, el yodo, el magnesio, el fósforo y el calcio, son útiles para la tiroides y las células nerviosas.
• Especiales en todas las convalecencias.
• Atemperantes en la hipertensión arterial.
• Son aperitivos especialmente, y curan todas las enfermedades del estomago y de los intestinos. En este caso no, hay fruta que les iguale.
• Eliminan del organismo los humores morbosos.
• Como aporta hierro, azufre, manganeso y potasio, favorecen la actividad de las hormonas sexuales y ayudan a generar enzimas.
• Un gran tónico de los organismos débiles.
• La piña también ayuda a regularizar la menstruación.
• Curan todas las enfermedades del hígado, ictericia. etc.
• Curan hidropesía e ictericia.
• Tónico cerebral, cura la neurastenia, melancolía, tristeza, perdida de memoria, idiotez, etc.
• Trata trastornos renales, hepáticos y biliares.
• Curan todas las inflamaciones del tubo digestivo.
• Elimina parásitos intestinales.
• Cuando se toman directamente maduros de la planta, tienen un perfume embriagador, y son de un color ligeramente ámbar dorado y son tan sabrosos y aromáticos que bien vale su peso en oro.
Levadura
Se denomina levadura a cualquiera de los diversos hongos microscópicos unicelulares que son importantes por su capacidad para realizar la descomposición mediante fermentación de diversos cuerpos orgánicos, principalmente los azúcares o hidratos de carbono, produciendo distintas sustancias.
Aunque en algunos textos de botánica se considera que las levaduras "verdaderas" pertenecen sólo a la clase Ascomycota, desde una perspectiva microbiológica se ha denominado levadura a todos los hongos con predominio de una fase unicelular en su ciclo de vida, incluyendo a los hongosbasidiomicetes.
A veces suelen estar unidos entre sí formando cadenas. Producen enzimas capaces de descomponer diversos sustratos, principalmente los azúcares.
Una de las levaduras más conocidas es la especie Saccharomyces cerevisiae. Esta levadura tiene la facultad de crecer en forma anaerobia1 realizandofermentación alcohólica.2 Por esta razón se emplea en muchos procesos de fermentación industrial, de forma similar a la levadura química, por ejemplo en la producción de cerveza, vino, hidromiel, aguol, pan, producción de antibióticos, etc.
Las levaduras se reproducen asexualmente por gemación o brotación y sexualmente mediante ascosporas o basidioesporas. Durante la reproducción asexual, una nueva yema surge de la levadura madre cuando se dan las condiciones adecuadas, tras lo cual la yema se separa de la madre al alcanzar un tamaño adulto. En condiciones de escasez de nutrientes las levaduras que son capaces de reproducirse sexualmente formarán ascosporas. Las levaduras que no son capaces de recorrer el ciclo sexual completo se clasifican dentro del género Candida.
La levadura es la primera célula eucariota en la que se ha intentado expresar proteínas recombinantes debido a que es de fácil uso industrial: es barata, cultivarla es sencillo y se duplica cada 90 minutos en condiciones nutritivas favorables. Además, es un organismo fácil de modificar genéticamente lo que permite realizar experimentos en varios días o semanas. Sin embargo, las levaduras poseen un mecanismo de glicosilación diferente al que se encuentra en células humanas, por lo que los productos son inmunogénicos.
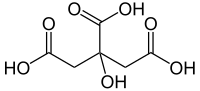
Ácido Cítrico
El ácido cítrico es un ácido orgánico tricarboxílico que está presente en la mayoría de las frutas, sobre todo en cítricos como el limón y la naranja. Su fórmula química es C6H8O7.
Es un buen conservante y antioxidante natural que se añade industrialmente como aditivo en el envasado de muchos alimentos como las conservas de vegetales enlatadas.
En bioquímica aparece como un metabolito intermediario en el ciclo de los ácidos tricarboxílicos, proceso realizado por la mayoría de los seres vivos.
El nombre IUPAC del ácido cítrico es ácido 2-hidroxi-1,2,3-propanotricarboxílico.
Ácido cítrico | |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Ácido 2-hidroxi- 1,2,3-propanotricarboxílico | |||
| General | |||
| Otros nombres | Ácido cítrico | ||
| Fórmula molecular | C6H8O7 | ||
| Identificadores | |||
| Número CAS | 77-92-9 | ||
| Propiedades físicas | |||
| Densidad | 1665 kg/m3; 1,665g/cm3 | ||
| Masa molar | 192,13 g/mol | ||
| Punto de fusión | 448 K (175 °C) | ||
| Propiedades químicas | |||
| Acidez (pKa) | 1=3,15; 2=4,77; 3=6,40 | ||
| Solubilidad enagua | 133 g/100 ml (22 °C) | ||
| Riesgos | |||
| Irrita piel y ojos. | |||
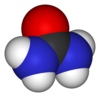
Urea
La urea es un compuesto químico cristalino bipolar e incoloro, de fórmula CO(NH2)2. Se encuentra abundantemente en los riñones y en la materia fecal. Es el principal producto terminal del metabolismo de proteínas en el hombre y en los demás mamíferos. La orina humana contiene unos 20g por litro, y un adulto elimina de 25 a 39g diariamente.
En cantidades menores, está presente en la sangre, en el hígado, en la linfa y en los fluidos serosos, y también en los excrementos de los peces y muchos otros animales. También se encuentra en el corazón, en los pulmones, en los huesos y en los órganos reproductivos así como el semen. La urea se forma principalmente en el hígado como un producto final del metabolismo. El nitrógeno de la urea, que constituye el 80% del nitrógeno en la orina, procede de la degradación de los diversos compuestos con nitrógeno, sobre todo de los aminoácidos de las proteínas en los alimentos. En los mamíferos la urea se forma en un ciclo metabólico denominado ciclo de la urea. La urea está presente también en los hongos así como en las hojas y semillas de numerosas legumbres y cereales.
Es soluble en agua y en alcohol, y ligeramente soluble en éter. Se obtiene mediante la síntesis de Wöhler, que fue diseñada en 1828 por el químico alemán Friedrich Wöhler, y fue la segunda sustancia orgánica obtenida artificialmente, luego del oxalato de amonio.
Urea | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Diaminocetona | |||
| General | |||
| Fórmula semidesarrollada | CO(NH2)2 | ||
| Fórmula estructural | Ver imagen. | ||
| Fórmula molecular | CON2H4 | ||
| Identificadores | |||
| Número CAS | [57-13-6 [57-13-6]] | ||
| Propiedades físicas | |||
| Densidad | 1340 kg/m3; 1,34g/cm3 | ||
| Masa molar | 60,06 g/mol | ||
| Punto de fusión | 405.8 K (132.7 °C) | ||
| Propiedades químicas | |||
| Acidez (pKa) | 0.18 | ||
| Solubilidad en agua | En agua: 108 g/100 ml (20 °C) 167 g/100 ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) 733 g/100 ml (100 °C) | ||
Sacarosa
La sacarosa o azúcar común es un disacárido formado por alfa-glucopiranosa y beta-fructofuranosa.
Su nombre químico es:
- beta-D-fructofuranosil-(2->1)-alfa-D-glucopiranósido.
Su fórmula química es:(C12H22O11)
El azúcar de mesa es el edulcorante más utilizado para endulzar los alimentos y suele ser sacarosa. En la naturaleza se encuentra en un 20% del peso en la caña de azúcar y en un 15% del peso de la remolacha azucarera, de la que se obtiene el azúcar de mesa. La miel también es un fluido que contiene gran cantidad de sacarosa parcialmente hidrolizada.
Sacarosa | |
| Nombre (IUPAC) sistemático | |
|---|---|
| n/d | |
| General | |
| Fórmula semidesarrollada | β-D-fructofuranosil-(2<->1)-α-D-glucopiranósido |
| Fórmula molecular | C12H22O11 |
| Identificadores | |
| Número CAS | 57-50-1 |
| Propiedades físicas | |
| Estado de agregación | sólido |
| Apariencia | cristales blancos |
| Densidad | 1587 kg/m3; 1.587 g/cm3 |
| Masa molar | 342,29648 g/mol g/mol |
| Punto de fusión | 459 K (185,85 °C) |
| Punto de descomposición | 459 K ( °C) |
| Propiedades químicas | |
| Acidez (pKa) | 12,62 |
| Solubilidad enagua | 203,9 g/100 ml (293K) |
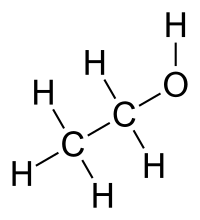
Etanol
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O), principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
Etanol | |||
| |||
| Nombre (IUPAC) sistemático | |||
|---|---|---|---|
| Etanol | |||
| General | |||
| Fórmula semidesarrollada | CH3-CH2-OH | ||
| Fórmula estructural | CH2OH-CH3 | ||
| Fórmula molecular | C2H6O | ||
| Identificadores | |||
| Número CAS | 64-17-5 | ||
| Propiedades físicas | |||
| Estado de agregación | Líquido | ||
| Apariencia | Incoloro | ||
| Densidad | 789 kg/m3; 0,789g/cm3 | ||
| Masa molar | 46,07 g/mol | ||
| Punto de fusión | 158.9 K (-114.3 °C) | ||
| Punto de ebullición | 351.6 K (78.4 °C) | ||
| Temperatura crítica | 514 K ( °C) | ||
| Viscosidad | 1.074 mPa·s a 20 °C. | ||
| Propiedades químicas | |||
| Acidez (pKa) | 15,9 | ||
| Solubilidad en agua | Miscible | ||
| Compuestos relacionados | |||
| alcoholes | Metanol, Propanol | ||
| Termoquímica | |||
| ΔfH0gas | -235,3 kJ/mol | ||
| ΔfH0líquido | -277,6 kJ/mol | ||
| S0líquido, 1 bar | 161,21 J·mol-1·K-1 | ||
| Peligrosidad | |||
| Punto de inflamabilidad | 286 K (13 °C) | ||
| NFPA 704 | |||
| Temperatura de autoignición | 636 K (363 °C) | ||
| Frases R | R11 R61 | ||
| Frases S | S2 S7 S16 | ||
| Límites de explosividad | 3.3 a 19% | ||







No hay comentarios:
Publicar un comentario